Trodelvy
Skrátená informácia o lieku 

Som odborníkom v zmysle § 8 ods. 5 písm. b) zákona č. 147/2001 Z. z. o reklame a o zmene a doplnení niektorých zákonov, čiže som osobou oprávnenou predpisovať lieky alebo osobou oprávnenou vydávať lieky v zmysle zákona č. 362/2011 Z. z. o liekoch a zdravotníckych pomôckach.

Osobitné upozornenia a opatrenia pri používaní zahŕňajú spätnú sledovateľnosť, neutropéniu, hnačku, hypersenzitivitu, nauzeu a vracanie, použitie u pacientov so zníženou aktivitou UGT1A1 a embryofetálnu toxicitu.
Trodelvy je v monoterapii indikovaný na liečbu dospelých pacientov s neresekovateľným alebo metastatickým triple-negatívnym karcinómom prsníka (mTNBC), ktorí podstúpili dve alebo viac predchádzajúcich systémových terapií, z ktorých aspoň jedna bola na pokročilé ochorenie.¹
 Tento liek podlieha ďalšiemu sledovaniu. Odkaz na skrátenú informáciu o TRODELVY nájdete vyššie. Prečítajte si, prosím, súhrn charakteristických vlastností lieku, kde nájdete úplné informácie o zvládaní nežiaducich reakcií.
Tento liek podlieha ďalšiemu sledovaniu. Odkaz na skrátenú informáciu o TRODELVY nájdete vyššie. Prečítajte si, prosím, súhrn charakteristických vlastností lieku, kde nájdete úplné informácie o zvládaní nežiaducich reakcií.
*ASCENT bolo medzinárodné, multicentrické, otvorené, randomizované klinické hodnotenie fázy 3 u pacientov s neresekovateľným lokálne pokročilým alebo metastatickým TNBC (n = 529). Pacienti boli randomizovaní v pomere 1 : 1, a to buď na liečbu TRODELVY 10 mg/kg i. v. v 1. a 8. deň 21-denného cyklu, alebo na chemoterapiu podľa výberu lekára (eribulín, vinorelbín, gemcitabín alebo kapecitabín). Primárnym cieľovým parametrom účinnosti bolo PFS u pacientov bez mozgových metastáz pri vstupe do klinického hodnotenia (88 % z celkovej študijnej populácie), podľa meraní BICR 75 využívajúcich kritériá RECIST v1.11
†Zlepšenie PFS a OS v populácii na primárnu analýzu bolo konzistentné s populáciou ITT (medián PFS: 5,6 mesiaca vs. 1,7 mesiaca; HR: 0,41; p < 0,0001; medián OS: 12,1 mesiaca vs. 6,7 mesiaca; p < 0,0001).¹
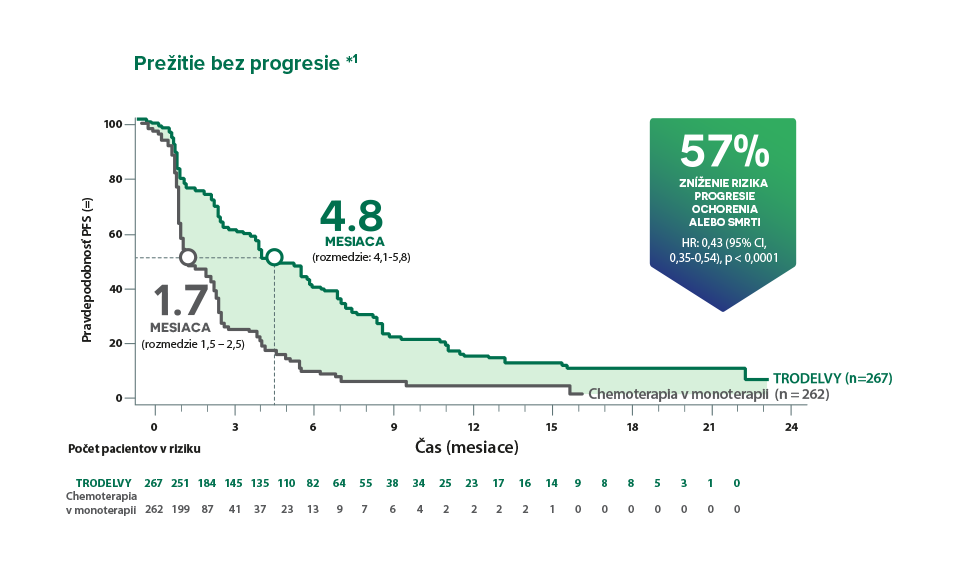
*Zlepšenie PFS v populácii na primárnu analýzu bolo konzistentné s populáciou ITT (medián PFS: 5,6 mesiaca vs. 1,7 mesiaca; HR: 0,41; p < 0,0001). Populácia na primárnu analýzu zahŕňala pacientov bez mozgových metastáz pri vstupe do štúdie (n = 468). Populácia ITT zahŕňala pacientov s metastázami v mozgu alebo bez nich pri vstupe do klinického hodnotenia (n = 529).4
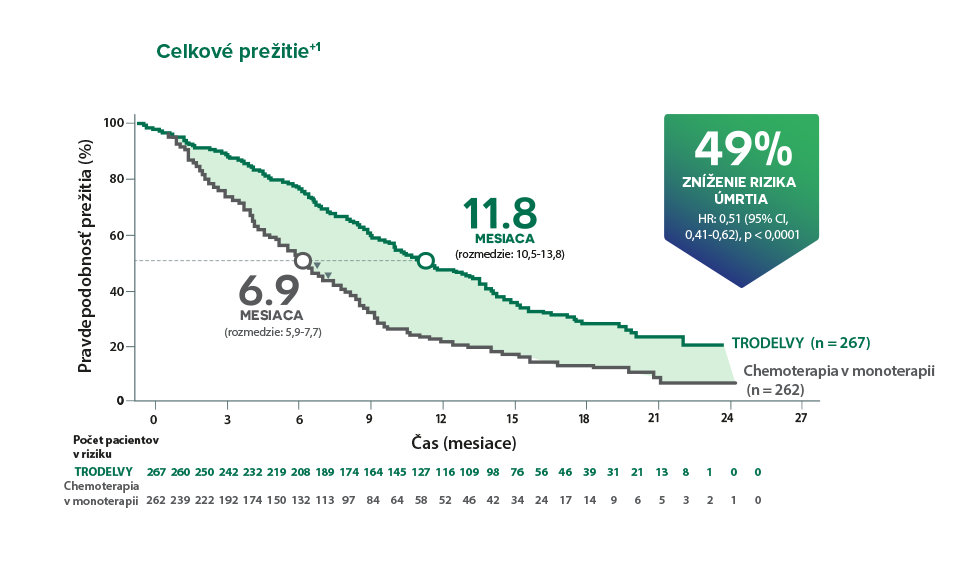
Zlepšenie OS v ramene s TRODELVY u pacientov s jednou predchádzajúcou líniou liečby pre metastatické ochorenie bolo konzistentné s výsledkami v celkovej populácii; HR: 0,514 (95% CI, 0,28-0,91).+1,2
*Zlepšenie OS v populácie na primárnu analýzu bolo konzistentné s populáciou ITT (medián OS: 12,1 mesiaca vs. 6,7 mesiaca; HR: 0,48; p < 0,0001). Populácia na primárnu analýzu zahŕňala pacientov bez mozgových metastáz pri vstupe do štúdie (n = 468). Populácia ITT zahŕňala pacientov s metastázami v mozgu alebo bez nich pri vstupe do klinického hodnotenia (n = 529).¹ †Post-hoc analýza populácie na primárnu analýzu.
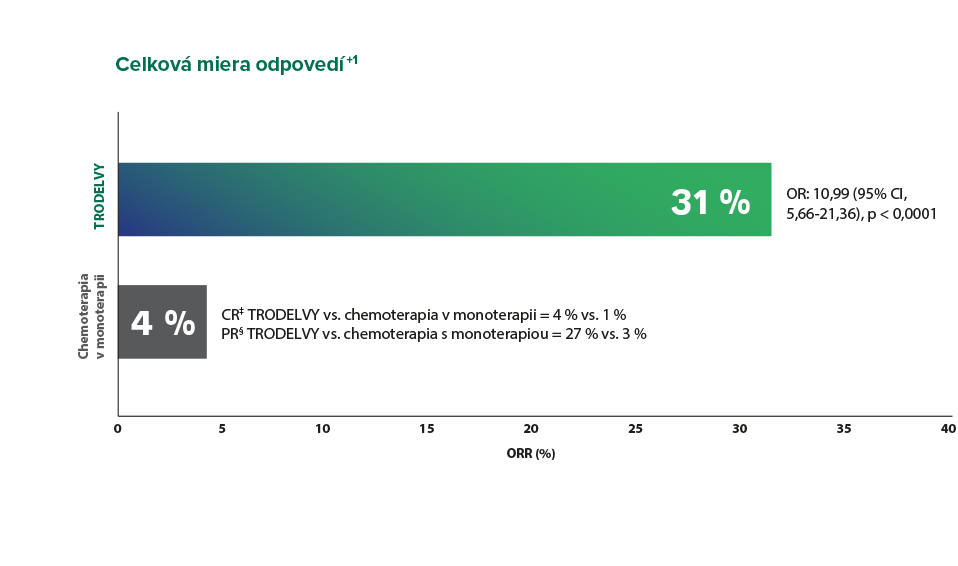
Medián trvania odpovede bol 6,3 mesiaca v ramene s TRODELVY (rozmedzie: 5,5 – 9,0) vs. 3,6 mesiaca so samotnou chemoterapiou (rozmedzie: 2,8 – NE)..¹
*Podľa Tabuľky 4 súhrnu charakteristických vlastností lieku, ktorá obsahuje mieru objektívnych odpovedí pre TRODELVY a samotnú chemoterapiu.
†Výsledky ORR pre populáciu na primárnu analýzu boli konzistentné s populáciou ITT (ORR: 35 % vs. 5 %; OR: 10,86; 95 % CI, 5,59 – 21,0). Populácia na primárnu analýzu zahŕňala pacientov bez mozgových metastáz pri vstupe do klinického hodnotenia (n = 468). Populácia ITT zahŕňala pacientov s metastázami v mozgu alebo bez nich pri vstupe do klinického hodnotenia (n = 529).¹
‡Kompletná odpoveď (CR): vymiznutie všetkých cieľových lézií. Všetky patologické lymfatické uzliny (cieľové aj necieľové) sa musia zmenšiť v krátkej osi na <10 mm.⁵
§Čiastočná odpoveď (PR): zmenšenie súčtu priemerov cieľových lézií aspoň o 30 % v porovnaní s pôvodným súčtom ich priemerov.⁵
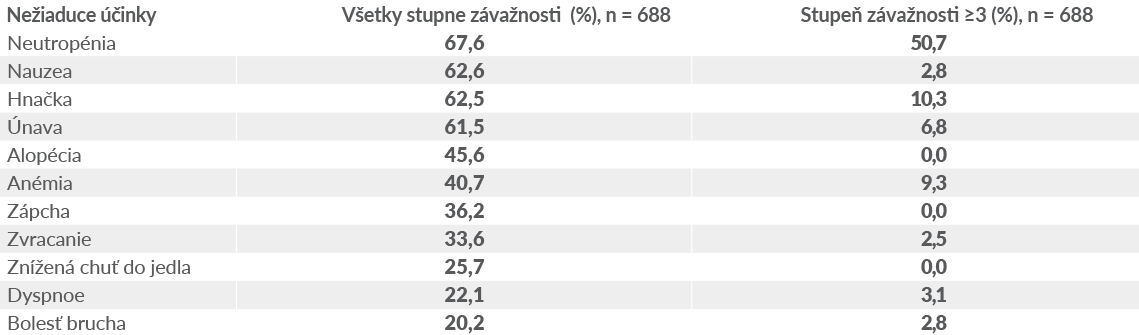
TRODELVY: NAJČASTEJŠIE NEŽIADUCE ÚČINKY1
Osobitné upozornenia a opatrenia pri používaní zahŕňajú spätnú sledovateľnosť, neutropéniu, hnačku, hypersenzitivitu, nauzeu a vracanie, použitie u pacientov so zníženou aktivitou UGT1A1 a embryofetálnu toxicitu.

Skrátená informácia o TRODELVY k dispozícii TU.
 Obsah
Obsah
2L+, druhá a vyššia línia; predchádzajúce liečby; ADC, konjugát protilátka-liečivo; BICR, zaslepená, nezávislá, centralizovaná kontrolná skupina rádiológov; CI, interval spoľahlivosti; HR, pomer rizík; HRQoL, kvalita života súvisiaca so zdravím; ITT, so zámerom liečiť; i. v., intravenózne; mTNBC, metastatický triple-negatívny karcinóm prsníka; NE, neodhadnuteľné; NÚ, nežiaduci účinok; OR, pomer šancí; ORR, miera objektívnych odpovedí; OS, celkové prežitie; PFS, prežitie bez progresie; PR, čiastočná odpoveď; RECIST, kritériá hodnotenia onkologickej odpovede pri solídnych tumoroch; TNBC, triple-negatívny karcinóm prsníka; Trop-2, trofoblastický povrchový antigén 2; QoL, kvalita života; UGT1A1, uridindifosfát glukuronosyltransferáza 1A1.
Referencie:
1. SPC Trodelvy.
2. Loibl S, et al. Eur J Cancer. 2023;178:23-33.
3. Rugo H, et al. Poster. SABCS [virtual meeting]. 2020 (abstr PS11- 09).
4. Bardia A, et al. N Engl J Med. 2021;384(16):1529-1541.
5. Eisenhauer EA, et al. Eur J Cancer. 2009;45(2):228-247
Dátum prípravy: august 2024
Schvaľovací kód: SL-TRO-0092
Návštevou našich stránok súhlasíte
s používaním Nastavenie súborov cookie
Gilead Sciences Slovakia s. r. o.
Laurinská 18
811 01 Bratislava
IČO: 47868520
© 1996 - 2025 Gilead Sciences Slovakia s. r. o.
Všetky práva vyhradené.